Su capacidad de diferenciación supera la
conseguida en el laboratorio.
El trabajo sugiere la posibilidad futura de
autoregeneración de tejidos lesionados.
JAIME
PRATS Valencia
Desde que
en 2009 se consiguió reprogramar simples células adultas de la piel para
transformarlas en células madre iPS o pluripotentes, tan versátiles como las
células madre embrionarias, este procedimiento siempre se había realizado en el
laboratorio.
Un equipo
del Centro Nacional de Investigaciones Oncológicas (CNIO) ha demostrado, por
vez primera, que el proceso de retrasar el reloj de las células adultas
(reprogramarlas) para convertirlas en iPS se puede provocar también en el
organismo de un ser vivo adulto. Pero, además, estas células madre, que se han
desarrollado en ratones, tienen mayor capacidad de diferenciación (de
convertirse en distintos tejidos) que las obtenidas en laboratorio. Esta nueva
técnica no tiene impacto terapéutico directo. Pero permite pensar en un futuro,
aún lejano, en el que sean los propios órganos lesionados los que puedan
producir células madre para regenerarse.
“Es un
trabajo excepcional”, reflexiona Juan Carlos Izpisúa, director del Centro de
Medicina Regenerativa de Barcelona. “Abre una nueva etapa para la medicina, la
búsqueda de estrategias que nos permitan regenerar órganos y tejidos de una
forma similar a los procesos naturales”.
El
trabajo del grupo de Manuel Serrano, director del programa de Oncología
Molecular del CNIO, lo publica Nature y parte de la técnica que le permitió al
investigador japonés Shinya Yamanaka obtener células madre iPS en 2007 y el
Nobel en 2012.
Yamanaka
reprogramó las células adultas introduciendo en ellas cuatro genes
característicos de la etapa embrionaria, de forma que, al activarse, devuelven
a la célula a un estadio prácticamente igual al de una célula embrionaria,
convirtiéndola en la famosa iPS. Serrano ha usado la misma combinación de
genes, el llamado coctel Yamanaka, pero le ha dado varias vueltas de tuerca,
con unos resultados sorprendentes e inesperados.
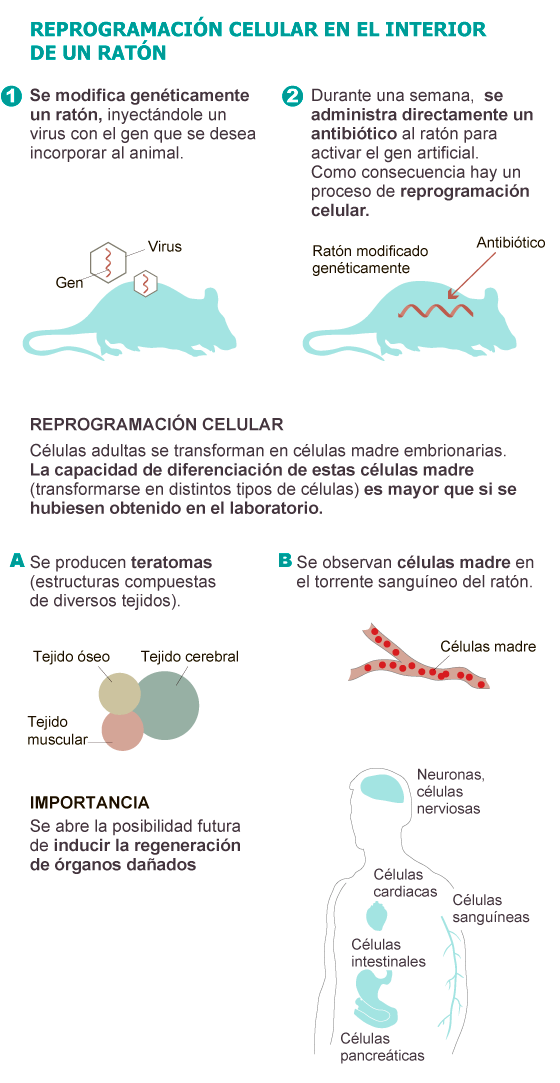
El equipo
del investigador español diseñó un ratón al que introdujo un gen artificial
que, en respuesta a la administración de un antibiótico —tetraciclina— se
activa y produce el mismo efecto que el coctel de las cuatro proteínas de
Yamanaka.
La
intención original de Serrano no era generar células madre iPS en el interior
de los roedores, sino algo “mucho más prosaico”, como traslada a este diario.
Buscaba una forma sencilla de obtener células madre embrionarias. Y la forma de
conseguirlas era extraer las células de los ratones con el genoma modificado,
bañarlas en una placa de laboratorio con el antibiótico y generar fácilmente
cultivos de células iPS.
Pero en
un momento dado, le surgió la duda. ¿Que sucedería si se administraba el
antibiótico directamente al ratón modificado genéticamente y no a los cultivos
de sus células? “Sinceramente, no confiábamos en que las células se fueran a
reprogramar dentro del ratón”, traslada el investigador. "No creíamos que
funcionara”, insiste. Pero funcionó.
Los
ratones modificados de Serrano bebieron el antibiótico diluido en agua durante
una semana. Al poner en marcha el mecanismo descrito por Yamanaka y adaptado
por el CNIO, los investigadores observaron que células adultas de los ratones
perdían sus características y adquirían rasgos de células embrionarias “que no
existen en los organismos adultos”, destaca Serrano.
Tras
retroceder, desprogramarse y convertirse en células madre, las células se
replicaban de forma descontrolada y desordenada en el interior del cuerpo de
los roedores dando lugar a una especie de masa compuesta de diferentes tejidos
(cerebral, muscular, óseo, intestinal...) de tejidos. Una especie de embrión
desorganizado denominado teratoma.
La
importancia de estas estructuras pseudoembrionarias que aparecían por decenas
en el tórax y en el abdomen no está en su utilidad clínica. Ninguna terapia
puede pasar por provocar teratomas. Lo relevante es que de esta forma quedaba
patente la elevada capacidad de diferenciación de las células madre generadas
en el interior de los ratones. Estas estructuras no solo contenían células
derivadas del desarrollo del embrión (de las tres capas que lo conforman), sino
incluso de tejidos externos al embrión, como es el caso de saco vitelino.
Además,
los investigadores del CNIO detectaron células madre en el torrente sanguíneo
de los ratones tratados
En ambos
casos —tanto en los teratomas como en la sangre— las células madre obtenidas
presentaban unos estadios embrionarios aún más tempranos que las células
producidas mediante la técnica de Yamanaka. Es decir, habían retrocedido a un
nivel más primitivo, por lo que presentaban una mayor facultad de
diferenciación en diferentes tipos celulares. Presentaban características de
embriones humanos de tan solo 72 horas de gestación y 16 células, que en la
jerga se denominan rasgos totipotentes.
Estas
características de indiferenciación tan elevadas “nunca se habían generado en
el laboratorio", según los autores. “Estos datos nos indican que nuestras
células madre son mucho más versátiles que las células iPS de Yamanaka”,
destaca Serrano. La contrapartida de esta facultad es que las células son más
difíciles de controlar cuando llega el momento de convertirlas en tejidos
concretos.
El
objetivo de la medicina regenerativa consiste en curar órganos dañados a través
de células sanas. La materia prima de este enfoque terapéutico son las células
madre por su capacidad de convertirse en cualquiera de los más de 100 tipos
celulares. Los especialistas aspiran a poder manipular estas células
desprogramadas para convertirlas en células sanas de hígado, corazón o páncreas
con las que tratar insuficiencias hepáticas, infartos o diabetes. O incluso
desarrollar en el laboratorio órganos completos de repuesto para sustituir a
los enfermos.
Las
células iPS cumplen estas condiciones de versatilidad. Y, además, no plantean
los problemas éticos que si presentan las células madre embrionarias humanas.
Por ello, los investigadores del CNIO plantean que la nueva fuente de células
madre que han descrito puede constituir una fuente alternativa a las que se
obtienen en el laboratorio para la investigación en medicina regenerativa.
“Nuestras células madre sobreviven también en cultivos fuera de los ratones”,
apunta María Abad, primera autora del artículo.
Pero
existe otra futura aplicación terapéutica más atractiva, aunque cuya aplicación
se muestra mucho más remota. Se trataría de aprovechar la capacidad de crear
células madre dentro del cuerpo para inducir la regeneración endógena en un
área dañada.
En los
procesos naturales de regeneración, las células sanas dirigen a las células
reparadoras. En el trabajo de los investigadores españoles, como explica
Serrano, la diferenciación inducida en las células adultas era tan alta que las
células madre eran insensibles a las señales del entorno y desarrollaban
teratomas.
Uno de
los próximos objetivos de los investigadores del CNIO consiste en determinar si
existe un grado de diferenciación que permita a las células madre iPS generadas
interactuar con su entorno y reparar por sí mismas, desde dentro, el tejido
lesionado. "Vamos a provocar daños en ratones, un infarto por ejemplo, y
administrar menos medicación, de forma que exista un menor grado de
reprogramación celular", comenta el investigador. “Queremos observar si
esas células menos diferenciadas pueden dar lugar a cardiomiocitos que mejoren
la función cardiaca”.
Este
cambio de concepto, el de inducir la regeneración terapéutica en lugar de crear
tejidos de repuesto en el laboratorio, evitaría riesgos derivados de las
intervenciones quirúrgicas a las que se deberían someter los pacientes para
recibir los órganos y tejidos reparadores. O accidentes en la manipulación de
los cultivos, entre otros.
El grupo
de Serrano no es el primero en plantear este enfoque. Un trabajo del Centro de
Medicina Regenerativa de Barcelona y el Instituto Salk anunció hace casi dos meses una nueva fórmula para generar iPS en
el laboratorio. En lugar de la receta Yamanaka (que consiste en despertar
cuatro genes activos en la etapa embrionaria, dos de los cuales inducen a la
formación de tumores), este grupo desarrolló un cóctel alternativo que pasaba
por alterar otros siete genes que ya están activos en las células adultas. Ello
abría la posibilidad reajustar la expresión de estos genes dentro del cuerpo
para que generaran células madre reparadoras en los propios tejidos. La misma
idea de la regeneración endógena órgano planteada por Serrano.
Todos
estos planteamientos de la medicina regenerativa suenan aún a ciencia ficción.
Y lo son. Aunque cada vez menos. Japón aprobó en junioel
primer intento de llevarlos a la práctica. Autorizó un ensayo para crear
retinas con células iPS para implantarlas en ciegos con degeneración macular.

No hay comentarios:
Publicar un comentario